市中心医院纪建松教授课题组在Nano Research发表研究论文
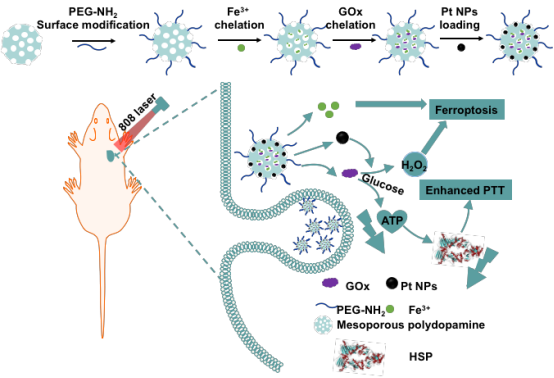
来源:丽水市中心医院 中心实验室 作者: 陈晓晓 发布日期:2022-02-17 08:56:151月16日,市中心医院纪建松教授课题组在Nano Research在线发表了题为“Biomimetic mesoporous polydopamine nanoparticles for MRI-guided photothermal-enhanced synergistic cascade chemodynamic cancer therapy”的研究论文。本研究报道了一种基于仿生介孔聚多巴胺载药系统在MRI引导下的协同、增强肿瘤化学动力学治疗(chemodynamic therapy)手段,将肿瘤内葡萄糖氧化从而诱导肿瘤组织富H2O2的微环境,通过Fenton反应将低毒性的H2O2催化成高细胞毒性羟基自由基,而基于介孔聚多巴胺的光热性能以及铂纳米酶的催化效能进一步增强CDT效应,从而实现高效的抑瘤作用,为肿瘤的精准、高效治疗提供了一种新的手段。

目前传统的抗肿瘤治疗手段,如手术切除、放疗和化疗等,对于实现精准、高效的抑制肿瘤增殖、转移的目标仍然具有一定的挑战性。近年来,基于纳米催化制剂的肿瘤化学动力学疗法(CDT)被认为是一种具有前景的抗肿瘤治疗方法。其中与肿瘤微环境(TME)引发的催化芬顿反应被认为是最具代表性的CDT,它采用多功能金属离子(例如Fe,Mn,Cu和Co)通过催化和分解反应性较低的过氧化氢(H2O2)将其转化为高细胞毒性的羟基自由基(•OH)来触发细胞内氧化应激,从而对细胞的脂质成分、蛋白质和DNA造成氧化损伤。然而,CDT的效应由于体内细胞H2O2含量低和不理想催化效率的限制,从而不能有效触发高强度催化芬顿反应。因此,迫切需要开发新的药物递送系统,使其能够在肿瘤部位诱发高强度的CDT,实现更为精准、高强度的杀伤肿瘤细胞效能。
针对上述问题,本研究构建了一种多功能纳米平台Pt@MPDA/GOx/Fe3+ NPs,实现MRI引导的光热增强、协同的肿瘤化学动力学治疗。该纳米平台为提高抗肿瘤CDT疗效提供了几个新的方法:1)GOx催化肿瘤内葡萄糖转化为H2O2,诱导形成富含H2O2的肿瘤微环境,并进一步和Fe2+发生Fenton反应,产生CDT抗肿瘤作用。2)基于聚多巴胺在激光照射下产生光热作用增强CDT效应。3)负载的Pt NPs可以氧化H2O2产生O2,从而提供更多的氧源来加速GOx的催化过程,从而提高CDT的效率。4)在肿瘤细胞的高氧化环境中,Pt NPs被氧化成Pt2+,达到肿瘤化疗效果。5)Fe3+离子不仅可以作为•OH生产中必不可少的元素,还可以作为MRI造影剂来监测肿瘤的位置和大小。
体外和体内研究结果均表明,激光照射Pt@MPDA/GOx/Fe3+ NPs可以通过PTT增强的CDT和化疗获得优异的抗癌效果。本研究提出的协同、增强的CDT治疗策略可以克服常规抗肿瘤模式的局限性,为开发安全、高性能的抗肿瘤治疗提供新思路。
本课题受到国家重点研发计划项目、国家自然科学基金项目以及浙江省自然科学基金项目的支持。
本文第一作者为纪建松教授的浙江大学2019级博士研究生张南南和浙江省影像诊断与介入微创研究重点实验室副研究员殳高峰博士,通讯作者为浙江大学丽水医院纪建松教授、浙江大学药学院杜永忠教授和浙江省影像诊断与介入微创研究重点实验室陈敏江博士。


